පළමුව, SiC ස්ඵටිකයේ ව්යුහය සහ ගුණාංග.
SiC යනු Si මූලද්රව්ය සහ C මූලද්රව්ය 1:1 අනුපාතයකින් සාදන ලද ද්විමය සංයෝගයකි, එනම් 50% සිලිකන් (Si) සහ 50% කාබන් (C) වන අතර එහි මූලික ව්යුහාත්මක ඒකකය SI-C tetrahedron වේ.
සිලිකන් කාබයිඩ් ටෙට්රාහෙඩ්රොන් ව්යුහයේ ක්රමානුකූල රූප සටහන
උදාහරණයක් ලෙස, Si පරමාණු ඇපල් ගෙඩියකට සමාන විෂ්කම්භයකින් විශාල වන අතර C පරමාණු තැඹිලි ගෙඩියකට සමාන විෂ්කම්භයකින් කුඩා වන අතර දොඩම් සහ ඇපල් සමාන සංඛ්යාවක් එකට ගොඩ ගසා SiC ස්ඵටිකයක් සාදයි.
SiC යනු ද්විමය සංයෝගයකි, එහි Si-Si බන්ධන පරමාණු පරතරය 3.89 A වේ, මෙම පරතරය තේරුම් ගන්නේ කෙසේද? දැනට වෙළඳපොලේ ඇති විශිෂ්ටතම ලිතෝග්රැෆි යන්ත්රයට ලිතෝග්රැෆි නිරවද්යතාවය 3nm වන අතර එය 30A දුරක් වන අතර ලිතෝග්රැෆි නිරවද්යතාවය පරමාණුක දුර මෙන් 8 ගුණයකි.
Si-Si බන්ධන ශක්තිය 310 kJ/mol වේ, එබැවින් බන්ධන ශක්තිය යනු මෙම පරමාණු දෙක වෙන් කරන බලය බවත්, බන්ධන ශක්තිය වැඩි වන තරමට ඔබට වෙන් කිරීමට අවශ්ය බලය වැඩි බවත් ඔබට තේරුම් ගත හැකිය.
උදාහරණයක් ලෙස, Si පරමාණු ඇපල් ගෙඩියකට සමාන විෂ්කම්භයකින් විශාල වන අතර C පරමාණු තැඹිලි ගෙඩියකට සමාන විෂ්කම්භයකින් කුඩා වන අතර දොඩම් සහ ඇපල් සමාන සංඛ්යාවක් එකට ගොඩ ගසා SiC ස්ඵටිකයක් සාදයි.
SiC යනු ද්විමය සංයෝගයකි, එහි Si-Si බන්ධන පරමාණු පරතරය 3.89 A වේ, මෙම පරතරය තේරුම් ගන්නේ කෙසේද? දැනට වෙළඳපොලේ ඇති විශිෂ්ටතම ලිතෝග්රැෆි යන්ත්රයට ලිතෝග්රැෆි නිරවද්යතාවය 3nm වන අතර එය 30A දුරක් වන අතර ලිතෝග්රැෆි නිරවද්යතාවය පරමාණුක දුර මෙන් 8 ගුණයකි.
Si-Si බන්ධන ශක්තිය 310 kJ/mol වේ, එබැවින් බන්ධන ශක්තිය යනු මෙම පරමාණු දෙක වෙන් කරන බලය බවත්, බන්ධන ශක්තිය වැඩි වන තරමට ඔබට වෙන් කිරීමට අවශ්ය බලය වැඩි බවත් ඔබට තේරුම් ගත හැකිය.
සිලිකන් කාබයිඩ් ටෙට්රාහෙඩ්රොන් ව්යුහයේ ක්රමානුකූල රූප සටහන
උදාහරණයක් ලෙස, Si පරමාණු ඇපල් ගෙඩියකට සමාන විෂ්කම්භයකින් විශාල වන අතර C පරමාණු තැඹිලි ගෙඩියකට සමාන විෂ්කම්භයකින් කුඩා වන අතර දොඩම් සහ ඇපල් සමාන සංඛ්යාවක් එකට ගොඩ ගසා SiC ස්ඵටිකයක් සාදයි.
SiC යනු ද්විමය සංයෝගයකි, එහි Si-Si බන්ධන පරමාණු පරතරය 3.89 A වේ, මෙම පරතරය තේරුම් ගන්නේ කෙසේද? දැනට වෙළඳපොලේ ඇති විශිෂ්ටතම ලිතෝග්රැෆි යන්ත්රයට ලිතෝග්රැෆි නිරවද්යතාවය 3nm වන අතර එය 30A දුරක් වන අතර ලිතෝග්රැෆි නිරවද්යතාවය පරමාණුක දුර මෙන් 8 ගුණයකි.
Si-Si බන්ධන ශක්තිය 310 kJ/mol වේ, එබැවින් බන්ධන ශක්තිය යනු මෙම පරමාණු දෙක වෙන් කරන බලය බවත්, බන්ධන ශක්තිය වැඩි වන තරමට ඔබට වෙන් කිරීමට අවශ්ය බලය වැඩි බවත් ඔබට තේරුම් ගත හැකිය.
උදාහරණයක් ලෙස, Si පරමාණු ඇපල් ගෙඩියකට සමාන විෂ්කම්භයකින් විශාල වන අතර C පරමාණු තැඹිලි ගෙඩියකට සමාන විෂ්කම්භයකින් කුඩා වන අතර දොඩම් සහ ඇපල් සමාන සංඛ්යාවක් එකට ගොඩ ගසා SiC ස්ඵටිකයක් සාදයි.
SiC යනු ද්විමය සංයෝගයකි, එහි Si-Si බන්ධන පරමාණු පරතරය 3.89 A වේ, මෙම පරතරය තේරුම් ගන්නේ කෙසේද? දැනට වෙළඳපොලේ ඇති විශිෂ්ටතම ලිතෝග්රැෆි යන්ත්රයට ලිතෝග්රැෆි නිරවද්යතාවය 3nm වන අතර එය 30A දුරක් වන අතර ලිතෝග්රැෆි නිරවද්යතාවය පරමාණුක දුර මෙන් 8 ගුණයකි.
Si-Si බන්ධන ශක්තිය 310 kJ/mol වේ, එබැවින් බන්ධන ශක්තිය යනු මෙම පරමාණු දෙක වෙන් කරන බලය බවත්, බන්ධන ශක්තිය වැඩි වන තරමට ඔබට වෙන් කිරීමට අවශ්ය බලය වැඩි බවත් ඔබට තේරුම් ගත හැකිය.
සෑම ද්රව්යයක්ම පරමාණු වලින් සෑදී ඇති බව අපි දනිමු, ස්ඵටිකයක ව්යුහය පරමාණු වල නිත්ය සැකැස්මකි, එය පහත දැක්වෙන පරිදි දිගු පරාසයක අනුපිළිවෙලක් ලෙස හැඳින්වේ. කුඩාම ස්ඵටික ඒකකය සෛලයක් ලෙස හැඳින්වේ, සෛලය ඝනක ව්යුහයක් නම්, එය සමීප ඇසුරුම් සහිත ඝනකයක් ලෙස හැඳින්වේ, සහ සෛලය ෂඩාස්රාකාර ව්යුහයක් වේ, එය සමීප ඇසුරුම් සහිත ෂඩාස්රාකාර ලෙස හැඳින්වේ.
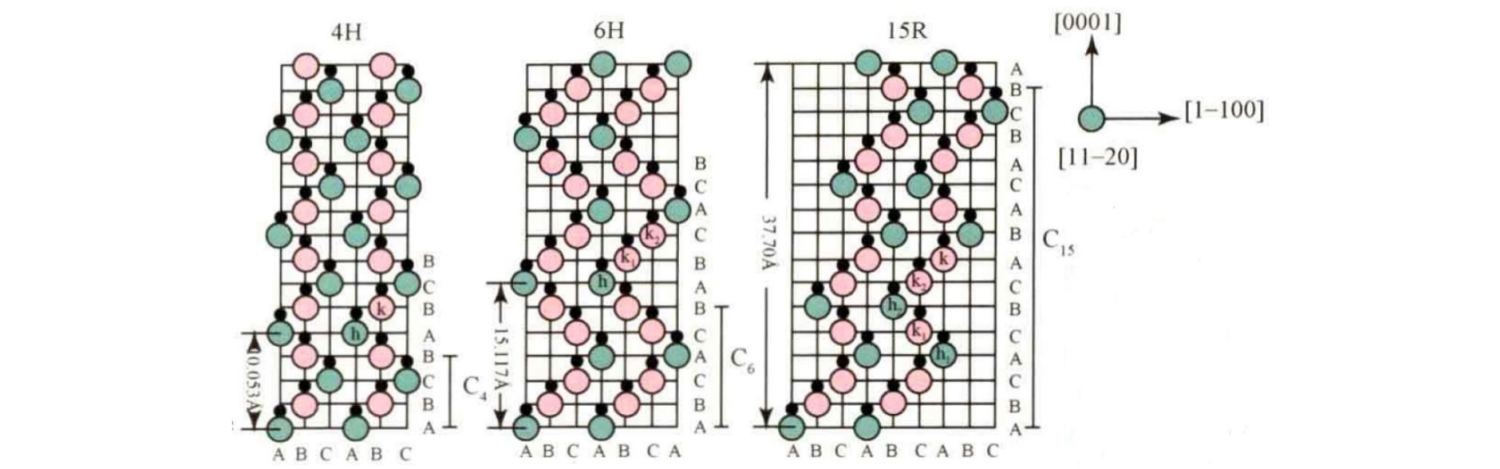
පොදු SiC ස්ඵටික වර්ගවලට 3C-SiC, 4H-SiC, 6H-SiC, 15R-SiC, ආදිය ඇතුළත් වේ. c අක්ෂය දිශාවට ඒවායේ ගොඩගැසීමේ අනුපිළිවෙල රූපයේ දැක්වේ.
ඒවා අතර, 4H-SiC හි මූලික ගොඩගැසීමේ අනුපිළිවෙල වන්නේ ABCB... ; 6H-SiC හි මූලික ගොඩගැසීමේ අනුපිළිවෙල ABCACB වේ... ; 15R-SiC හි මූලික ගොඩගැසීමේ අනුපිළිවෙල ABCACBCABACABCB වේ... .
මෙය නිවසක් තැනීමට ගඩොලක් ලෙස දක්නට හැකිය, සමහර නිවෙස්වල ගඩොල් තැබීමේ ක්රම තුනක් ඇත, සමහරුන්ට ඒවා තැබීමේ ක්රම හතරක් ඇත, තවත් සමහරුන්ට මාර්ග හයක් ඇත.
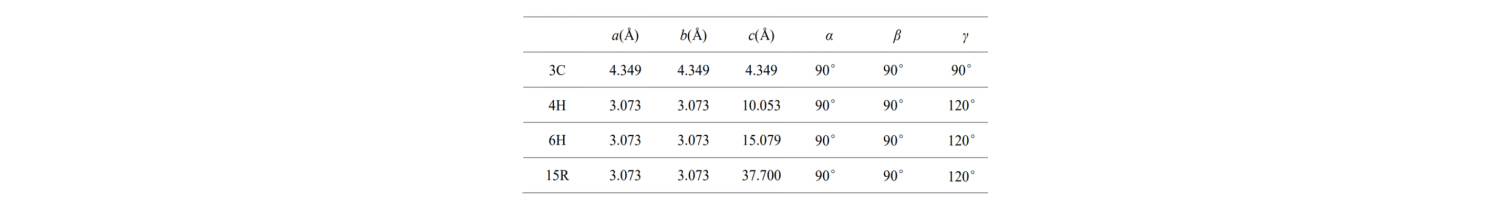
මෙම පොදු SiC ස්ඵටික වර්ගවල මූලික සෛල පරාමිතීන් වගුවේ දක්වා ඇත:
a, b, c සහ කෝණයන් අදහස් කරන්නේ කුමක්ද? SiC අර්ධ සන්නායකයක ඇති කුඩාම ඒකක සෛලයේ ව්යුහය පහත පරිදි විස්තර කෙරේ.
එකම සෛලයකදී, ස්ඵටික ව්යුහය ද වෙනස් වනු ඇත, මෙය අපි ලොතරැයිය මිලදී ගන්නවා වගේ, ජයග්රාහී අංකය 1, 2, 3, ඔබ 1, 2, 3 අංක තුනක් මිලදී ගත්තා, නමුත් අංකය වර්ග කර ඇත්නම් වෙනස් ලෙස, ජයග්රාහී මුදල වෙනස් වේ, එබැවින් එකම ස්ඵටිකයේ අංකය සහ අනුපිළිවෙල එකම ස්ඵටිකයක් ලෙස හැඳින්විය හැක.
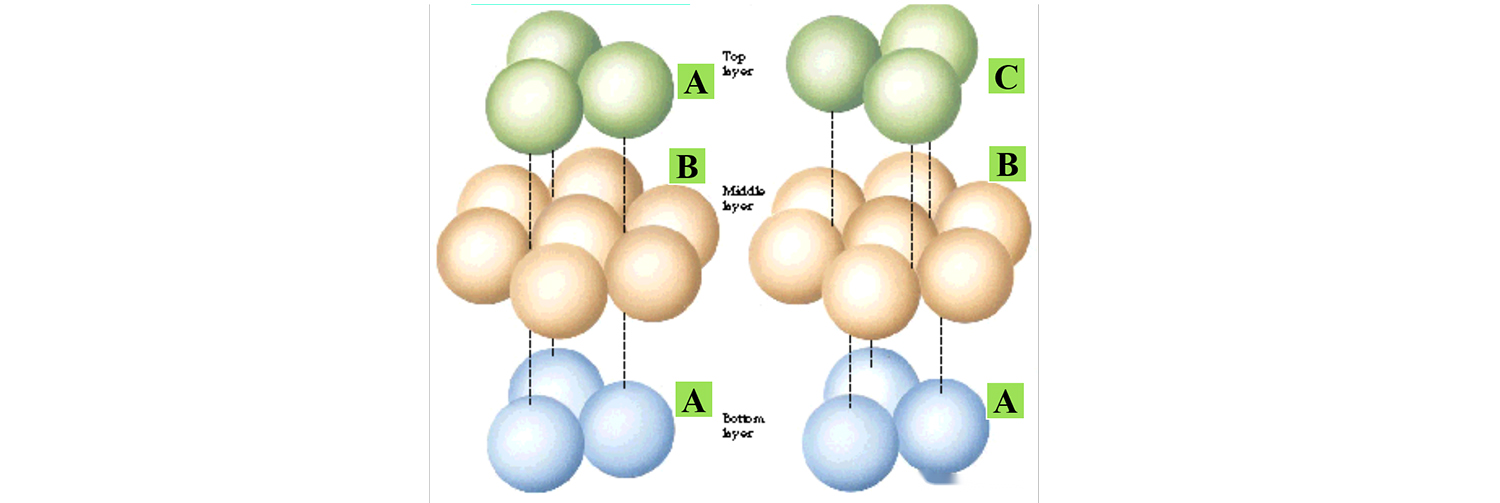
පහත රූපයේ දැක්වෙන්නේ සාමාන්ය ස්ටැකිං මාදිලි දෙකයි, ඉහළ පරමාණුවල ස්ටැකිං මාදිලියේ වෙනස පමණක්, ස්ඵටික ව්යුහය වෙනස් වේ.
SiC විසින් සාදන ලද ස්ඵටික ව්යුහය උෂ්ණත්වයට දැඩි ලෙස සම්බන්ධ වේ. 1900~2000 ℃ ඉහළ උෂ්ණත්වයේ ක්රියාව යටතේ, 3C-SiC එහි දුර්වල ව්යුහාත්මක ස්ථායිතාව නිසා 6H-SiC වැනි ෂඩාස්ර SiC බහුආකෘතියක් බවට සෙමෙන් පරිවර්තනය වේ. එය හරියටම SiC බහුරූපී සෑදීමේ සම්භාවිතාව සහ උෂ්ණත්වය අතර ඇති ශක්තිමත් සහසම්බන්ධය සහ 3C-SiC හි අස්ථාවරත්වය නිසා 3C-SiC හි වර්ධන වේගය වැඩි දියුණු කිරීම දුෂ්කර වන අතර සකස් කිරීම දුෂ්කර ය. 4H-SiC සහ 6H-SiC හි ෂඩාස්රාකාර පද්ධතිය වඩාත් සුලභ හා සකස් කිරීමට පහසු වන අතර ඒවායේම ලක්ෂණ නිසා පුළුල් ලෙස අධ්යයනය කරනු ලැබේ.
SiC ස්ඵටිකයේ SI-C බන්ධනයේ බන්ධන දිග 1.89A පමණක් වන නමුත් බන්ධන ශක්තිය 4.53eV තරම් ඉහළය. එබැවින්, බන්ධන තත්ත්වය සහ ප්රති-බන්ධන තත්ත්වය අතර ශක්ති මට්ටමේ පරතරය ඉතා විශාල වන අතර, පුළුල් කලාප පරතරයක් සෑදිය හැක, එය Si සහ GaAs මෙන් කිහිප ගුණයකි. ඉහළ කලාප පරතරය පළල යනු ඉහළ උෂ්ණත්ව ස්ඵටික ව්යුහය ස්ථායී බවයි. සම්බන්ධිත බල ඉලෙක්ට්රොනික උපකරණවලට ඉහළ උෂ්ණත්වවලදී ස්ථායී ක්රියාකාරිත්වයේ ලක්ෂණ සහ සරල කළ තාප විසර්ජන ව්යුහය අවබෝධ කර ගත හැකිය.
Si-C බන්ධනය තදින් බැඳීම නිසා දැලිසට ඉහළ කම්පන සංඛ්යාතයක් ඇති කරයි, එනම් ඉහළ ශක්ති ෆොනෝනයක්, එනම් SiC ස්ඵටිකයට ඉහළ සන්තෘප්ත ඉලෙක්ට්රෝන සංචලතාවක් සහ තාප සන්නායකතාවක් ඇති බවත්, ඊට අදාළ බල ඉලෙක්ට්රොනික උපාංගවලට a ඉහළ මාරු වීමේ වේගය සහ විශ්වසනීයත්වය, එය උපාංගයේ අධික උෂ්ණත්වය අසාර්ථක වීමේ අවදානම අඩු කරයි. ඊට අමතරව, SiC හි ඉහළ බිඳවැටීමේ ක්ෂේත්ර ශක්තිය එයට ඉහළ මාත්රණ සාන්ද්රණයක් ලබා ගැනීමට සහ අඩු ප්රතිරෝධයක් ලබා ගැනීමට ඉඩ සලසයි.
දෙවනුව, SiC ස්ඵටික වර්ධනයේ ඉතිහාසය
1905 දී, ආචාර්ය හෙන්රි මොයිසන් ආවාටයේ ස්වභාවික SiC ස්ඵටිකයක් සොයා ගත් අතර, එය දියමන්තියකට සමාන බව සොයා ගත් අතර එය Mosan දියමන්ති ලෙස නම් කරන ලදී.
ඇත්ත වශයෙන්ම, 1885 තරම් මුල් භාගයේදී, Acheson විසින් SiC ලබා ගත්තේ සිලිකා සමඟ කෝක් මිශ්ර කර විදුලි උදුනක රත් කිරීමෙන් ය. එකල මිනිසුන් එය දියමන්ති මිශ්රණයක් ලෙස වරදවා වටහාගෙන එය හැඳින්වූයේ එමරි යනුවෙනි.
1892 දී, Acheson සංස්ලේෂණ ක්රියාවලිය වැඩිදියුණු කර, ඔහු ක්වාර්ට්ස් වැලි, කෝක්, ලී කැබලි කුඩා ප්රමාණයක් සහ NaCl මිශ්ර කර, එය විද්යුත් චාප උදුනක 2700℃ දක්වා රත් කර, කොරපොතු SiC ස්ඵටික සාර්ථකව ලබා ගත්තේය. SiC ස්ඵටික සංස්ලේෂණය කිරීමේ මෙම ක්රමය Acheson ක්රමය ලෙස හඳුන්වන අතර එය තවමත් කර්මාන්තයේ SiC උල්ෙල්ඛ නිෂ්පාදනය කිරීමේ ප්රධාන ධාරාවේ ක්රමය වේ. කෘතිම අමුද්රව්යවල අඩු සංශුද්ධතාවය සහ රළු සංස්ලේෂණ ක්රියාවලිය හේතුවෙන්, Acheson ක්රමය මඟින් වැඩි SiC අපද්රව්ය, දුර්වල ස්ඵටික අඛණ්ඩතාව සහ කුඩා ස්ඵටික විෂ්කම්භය නිපදවන අතර, විශාල ප්රමාණයේ, ඉහළ සංශුද්ධතාවය සහ ඉහළ අර්ධ සන්නායක කර්මාන්තයේ අවශ්යතා සපුරාලීමට අපහසු වේ. ගුණාත්මක ස්ඵටික, සහ ඉලෙක්ට්රොනික උපාංග නිෂ්පාදනය සඳහා භාවිතා කළ නොහැක.
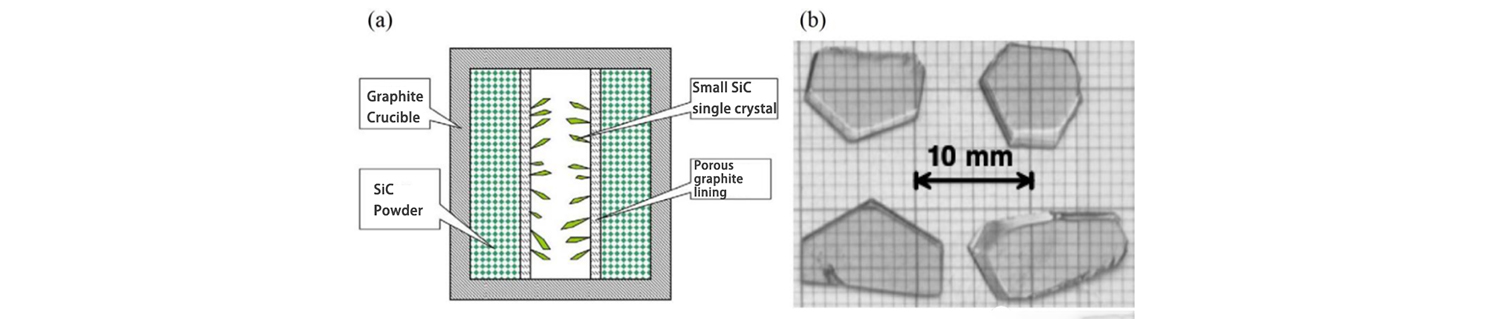
Lely of Philips Laboratory විසින් 1955 දී SiC තනි ස්ඵටික වගා කිරීම සඳහා නව ක්රමයක් යෝජනා කරන ලදී. මෙම ක්රමයේදී මිනිරන් ක්රුසිබල් වර්ධන යාත්රාව ලෙසද SiC කුඩු ස්ඵටික SiC ස්ඵටික වර්ධනය සඳහා අමුද්රව්ය ලෙසද හුදකලා කිරීමට සිදුරු සහිත මිනිරන් භාවිතා කරයි. වැඩෙන අමුද්රව්ය මධ්යයේ සිට හිස් ප්රදේශයක්. වර්ධනය වන විට, මිනිරන් කූඩය Ar හෝ H2 වායුගෝලය යටතේ 2500℃ දක්වා රත් කරනු ලබන අතර, පර්යන්ත SiC කුඩු Si සහ C වාෂ්ප අදියර ද්රව්ය බවට වියෝජනය කර, වායුවෙන් පසු මැද කුහර කලාපයේ SiC ස්ඵටික වර්ධනය වේ. ප්රවාහය සිදුරු සහිත ග්රැෆයිට් හරහා සම්ප්රේෂණය වේ.
තෙවනුව, SiC ස්ඵටික වර්ධන තාක්ෂණය
SiC හි තනි ස්ඵටික වර්ධනය එහිම ලක්ෂණ නිසා අපහසු වේ. මෙයට ප්රධාන වශයෙන් හේතු වී ඇත්තේ වායුගෝලීය පීඩනයේදී Si: C = 1:1 ස්ටෝචියෝමිතික අනුපාතයක් සහිත ද්රව අවධියක් නොමැති වීම සහ අර්ධ සන්නායකයේ වත්මන් ප්රධාන ධාරාවේ වර්ධන ක්රියාවලිය මගින් භාවිතා කරන වඩාත් පරිණත වර්ධන ක්රම මගින් එය වගා කළ නොහැකි වීමයි. කර්මාන්තය - cZ ක්රමය, වැටෙන crucible ක්රමය සහ අනෙකුත් ක්රම. න්යායාත්මක ගණනය කිරීම් වලට අනුව, පීඩනය 10E5atm ට වඩා වැඩි වන විට සහ උෂ්ණත්වය 3200℃ ට වඩා වැඩි වූ විට පමණක් Si: C = 1:1 ද්රාවණයේ ස්ටෝචියෝමිතික අනුපාතය ලබා ගත හැක. මෙම ගැටළුව මඟහරවා ගැනීම සඳහා විද්යාඥයින් විසින් ඉහළ ස්ඵටික ගුණාත්මක, විශාල ප්රමාණයේ සහ ලාභ SiC ස්ඵටික ලබා ගැනීම සඳහා විවිධ ක්රම යෝජනා කිරීමට අසීමිත උත්සාහයන් ගෙන ඇත. වර්තමානයේ ප්රධාන ක්රම වන්නේ PVT ක්රමය, ද්රව අදියර ක්රමය සහ අධික උෂ්ණත්ව වාෂ්ප රසායනික තැන්පත් කිරීමේ ක්රමයයි.
පසු කාලය: ජනවාරි-24-2024